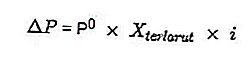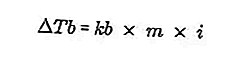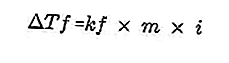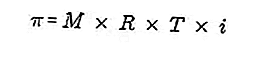ลองหันมาสนใจสิ่งที่อยู่รอบตัวเราเกี่ยวข้องกับเคมี? วิธีที่ง่ายที่สุดคืออากาศที่เราหายใจซึ่งมีส่วนผสมของออกซิเจนไนโตรเจนและก๊าซอื่น ๆ เครื่องปรุงรสอาหารสีผสมอาหารและสารถนอมอาหารก็เป็นตัวอย่างสารเคมีอื่น ๆ ที่อยู่รอบตัวเราเช่นกัน เคมีเป็นสาขาหนึ่งของวิทยาศาสตร์ธรรมชาติที่คุณจะได้เรียนในโรงเรียนที่ศึกษาเกี่ยวกับวัสดุต่างๆตัวอย่างหนึ่งคือโครงสร้างของสสารสมบัติของสสารรูปแบบวัสดุการเปลี่ยนแปลงของสสารการจำแนกประเภทของสสารการจัดเรียงสสารและพลังงานที่มาพร้อมกับการเปลี่ยนแปลงเหล่านี้ ไม่เพียง แต่คณิตศาสตร์และฟิสิกส์เคมียังมีสูตรอีกหลายประเภทด้วย มีสูตรทางเคมีมากมายที่คุณจะได้เรียนรู้ตั้งแต่คุณสมบัติเชิงเปรียบเทียบไปจนถึงปฏิกิริยารีดอกซ์
ในโอกาสนี้เราจะได้เรียนรู้สูตรทางเคมีต่างๆและตัวอย่างปัญหาซึ่งจะช่วยให้คุณเข้าใจแนวคิดของสูตรทางเคมี
สูตรทางเคมีและปัญหาตัวอย่าง
การปรากฏตัวของสูตรทางเคมีคือการช่วยให้นักวิจัยสามารถค้นหาผลการทดลองประเภทต่างๆที่จะดำเนินการได้ เพื่อให้สามารถเชี่ยวชาญวิทยาศาสตร์นี้ได้ดีคุณต้องรู้สูตรทางเคมีบางอย่างที่คุณมักจะพบเมื่อเรียนเคมี
สูตรสำหรับคุณสมบัติ Colligative ของสารละลาย
ลักษณะการเรียงตัวของสารละลายเป็นลักษณะของสารละลายที่ไม่ขึ้นอยู่กับชนิดของสารที่ละลายน้ำได้ แต่ขึ้นอยู่กับความเข้มข้นของอนุภาคของสารละลายเท่านั้น จากนั้นลักษณะการเรียงตัวของสารละลายประกอบด้วยคุณสมบัติสองประเภท ได้แก่ ลักษณะการเรียงตัวของสารละลายอิเล็กโทรไลต์และลักษณะการเรียงตัวของสารละลายที่ไม่ใช่อิเล็กโทร
- คุณสมบัติการรวมตัวของสารละลายที่ไม่ใช่อิเล็กโทรไลต์
แม้ว่าลักษณะ colligative จะเกี่ยวข้องกับสารละลาย แต่ลักษณะ colligative ไม่ได้ขึ้นอยู่กับปฏิสัมพันธ์ของโมเลกุลของตัวถูกละลายและตัวถูกละลาย แต่ด้วยปริมาณของตัวถูกละลายที่ละลายในสารละลาย คุณสมบัติการรวมตัวกันประกอบด้วยการลดลงของความดันไอการเพิ่มขึ้นของจุดเดือดการลดลงของจุดเยือกแข็งและความดันออสโมติก แต่ละคนต้องใช้สูตรทางเคมีเพื่อให้ได้ผลลัพธ์
- สมการความดันไอน้ำลดลง

ที่มา: formula.co.id
- สมการเพิ่มจุดเดือด
จุดเดือดของของเหลวคืออุณหภูมิคงที่ที่เดือด ที่อุณหภูมินี้ความดันไอของของเหลวมีสมการเป็นความดันอากาศรอบ ๆ ตัวและเกิดจากการระเหยของของเหลวทุกส่วน จุดเดือดของของเหลวสามารถวัดได้โดยความดัน 1 บรรยากาศ
ความแตกต่างของจุดเดือดของสารละลายและจุดเดือดของตัวทำละลายบริสุทธิ์เรียกว่าการเพิ่มขึ้นของจุดเดือดสมการของการเพิ่มขึ้นของจุดเดือดคือ:

ที่มา: formula.co.id
- สมการการลดลงของจุดเยือกแข็ง
ตัวถูกละลายที่มีอยู่ในสารละลายจะทำให้จุดเยือกแข็งของสารละลายมีขนาดเล็กกว่าจุดเยือกแข็งของตัวทำละลาย สมการการลดจุดเยือกแข็ง:

ที่มา: formula.co.id
- แรงดันออสโมซิส
แรงดันออสโมติกเป็นแรงที่ต้องใช้ในการปรับสมดุลความดันของตัวทำละลายจากเมมเบรนแบบกึ่งสังเคราะห์ผ่านสารละลาย
เมมเบรนกึ่งสังเคราะห์เป็นเมมเบรนที่โมเลกุลของตัวทำละลายสามารถผ่านได้ แต่ตัวถูกละลายไม่สามารถผ่านได้ ตาม Van't Hoff ที่ความดันออสโมติกจะมีสูตรดังนี้:

ที่มา: formula.co.id
- Colligative Properties ของสารละลายอิเล็กโทรไลต์
ในความเข้มข้นคุณสมบัติการเรียงตัวของสารละลายอิเล็กโทรไลต์เดียวกันมีค่ามากกว่าเมื่อเราเปรียบเทียบกับคุณสมบัติการเรียงตัวของสารละลายที่ไม่ใช่อิเล็กโทรไลต์ เนื่องจากอนุภาคตัวถูกละลายจำนวนมากเป็นผลมาจากปฏิกิริยาไอออไนเซชันของสารละลายอิเล็กโทรไลต์ซึ่งได้รับการกำหนดสูตรในปัจจัย Van't Hoff
การคำนวณคุณสมบัติการเรียงตัวของสารละลายอิเล็กโทรไลต์จะคูณด้วยปัจจัย Van't Hoff เสมอดังนี้:

ที่มา: formula.co.id
สูตรบางส่วนสำหรับคุณสมบัติการรวมตัวของสารละลายอิเล็กโทรไลต์อื่น ๆ ได้แก่ :
- ความดันไอลดลง
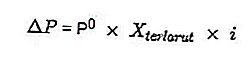
ที่มา: formula.co.id
- จุดเดือดเพิ่มขึ้น
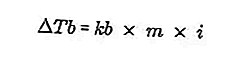
ที่มา: formula.co.id
- จุดเยือกแข็งลดลง
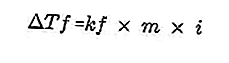
ที่มา: formula.co.id
- แรงดันออสโมซิส
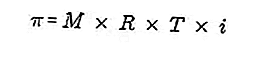
ที่มา: formula.co.id
สูตรโมลาริตีโมลาลิตี้และโมลเศษส่วน
โมลาริตี (M)
โมลาริตีคือจำนวนโมลของสารที่ละลายในสารละลาย 1 ลิตร

ที่มา: formula.co.id
M = โมลาริตี
Mr = มวลโมลาร์ของตัวถูกละลาย (g / mol)
V = ปริมาตรของสารละลาย
Molality (ม.)
Molality คือจำนวนโมลของสารที่ละลายในตัวทำละลาย 1 กิโลกรัม สูตรทางเคมีมีดังนี้

ที่มา: formula.co.id
m = molality (โมล / กก.)
Mr = มวลโมลาร์ของตัวถูกละลาย (g / mol)
มวล = มวลของตัวถูกละลาย (g)
P = มวลของตัวทำละลาย (g)
เศษส่วนโมล
เศษส่วนโมลคือหน่วยของความเข้มข้นซึ่งส่วนประกอบทั้งหมดของสารละลายคำนวณโดยอาศัยโมล

ที่มา: formula.co.id
xi = จำนวนโมล
i, j, xj = โมลเศษส่วน
ตัวอย่างโจทย์สูตรเคมี
1. ถ้าความดันออสโมติกของสารละลายฟรุกโตส 500 มล. C6H12O6 จาก 32 ° C เท่ากับ 2 atm มวลของฟรุกโตสละลายคืออะไร?
วิธีการแก้:

2. ในส่วนโมลของสารละลายยูเรียในน้ำ 0.2 ความดันไอน้ำอิ่มตัวของน้ำบริสุทธิ์ที่อุณหภูมิ 20 ° C คือ 17.5 mmHg แล้วที่ความดันไออิ่มตัวของสารละลายที่อุณหภูมิต่อไปนี้คืออะไร?
X ยูเรีย + X น้ำ = 1
0.2 + X น้ำ = 1
X น้ำ = 0.8
สารละลาย P = X น้ำ x น้ำ P
P ของสารละลาย = 0.8 x 17.5 mmHg
P ของสารละลาย = 14 mmHg
นี่คือสูตรทางเคมีบางส่วนที่คุณสามารถเรียนรู้เพื่อช่วยให้คุณตอบคำถามเคมีประเภทต่างๆได้ง่ายขึ้น หากคุณรู้สึกว่าสูตรเหล่านี้ยังไม่เพียงพอคุณสามารถลองใช้ผลิตภัณฑ์ PROBLEM ซึ่งเป็นโซลูชันแบบฝึกออนไลน์แบบถ่วงน้ำหนักและครบถ้วนสำหรับ Smart Class เช่นตรีโกณมิติลิมิตลอการิทึมและอื่น ๆ อีกมากมาย เริ่มตั้งแต่ระดับประถมศึกษาตอนต้นถึงมัธยมศึกษาตอนปลายโดยมีวิชาต่างๆเช่นคณิตศาสตร์ฟิสิกส์เคมีและอื่น ๆ ที่นี่คุณสามารถเรียนรู้สูตรต่างๆพร้อมตัวอย่างปัญหา
มาสิรออะไร! มาลองแบบฝึกหัด PROBLEM ใน Smart Class กันเลย