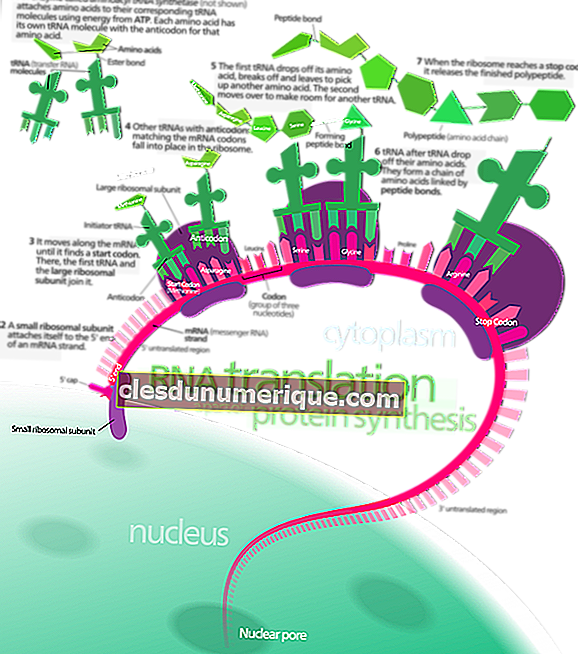
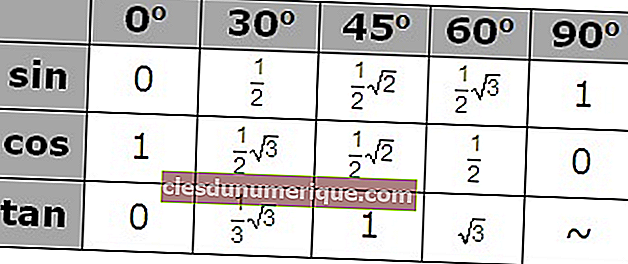
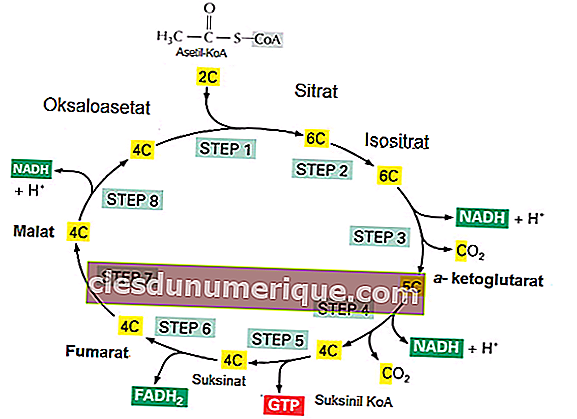
เคมีธาตุเป็นสาขาวิชาเคมีที่ศึกษาองค์ประกอบที่ค้นพบโดยเฉพาะ นอกจากนี้ยังตรวจสอบคุณสมบัติทางกายภาพและทางเคมีขององค์ประกอบ คุณสมบัติทางกายภาพหมายถึงการเปลี่ยนแปลงวัตถุโดยไม่สร้างสสารใหม่ คุณสมบัติทางกายภาพยังสามารถสังเกตได้โดยไม่ต้องเปลี่ยนสารที่ประกอบเป็นวัสดุ เราสามารถจำแนกคุณสมบัติทางกายภาพของสารสีกลิ่นจุดหลอมเหลวจุดเดือดความหนาแน่นความแข็งความสามารถในการละลายความขุ่นแม่เหล็กและความหนืด
ในขณะเดียวกันคุณสมบัติทางเคมีคือการเปลี่ยนแปลงที่เกิดจากวัตถุที่ก่อตัวเป็นสารใหม่ การเปลี่ยนแปลงทางเคมีทำให้สารรูปแบบหนึ่งเป็นสารชนิดใหม่ ตัวอย่างคุณสมบัติทางเคมีบางส่วน ได้แก่ ความไวไฟความสามารถในการติดไฟระเบิดได้เป็นพิษและเป็นสนิมหรือมีฤทธิ์กัดกร่อน
องค์ประกอบสามารถแบ่งได้ตามตำแหน่งบนตารางธาตุ คราวนี้เราจะพูดถึงคุณสมบัติทางกายภาพและคุณสมบัติทางเคมีของธาตุตามกลุ่มของพวกมัน
กลุ่มอัลคาไล
โลหะอัลคาไลเป็นองค์ประกอบที่อยู่ในกลุ่ม IA ยกเว้นไฮโดรเจน (H) ได้แก่ ลิเธียม (Li) โซเดียม (Na) โพแทสเซียม (K) รูบิเดียม (Rb) ซีเซียม (Cs) และแฟรนเซียม (Fr) ในบรรดาคุณสมบัติทางกายภาพของกลุ่มอัลคาไลน์คือคุณสมบัติที่อ่อนนุ่มและเบา องค์ประกอบเหล่านี้ยังมีจุดหลอมเหลวและจุดเดือดค่อนข้างต่ำ
คุณสมบัติทางเคมีขององค์ประกอบโลหะอัลคาไลคือการเกิดปฏิกิริยาสูง โลหะอัลคาไลนั้นติดไฟได้โดยออกซิเจนในอากาศดังนั้นจึงต้องเก็บไว้ในน้ำมันก๊าด ผลของการเผาไหม้จะอยู่ในรูปของเปอร์ออกไซด์เสมอ
(อ่านเพิ่มเติม: Atom Models, What Are You?)
องค์ประกอบของโลหะอัลคาไลยังมีปฏิกิริยากับน้ำมาก ลำดับขององค์ประกอบลดลงปฏิกิริยารุนแรงขึ้นอาจทำให้เกิดความร้อนได้ โลหะอัลคาไลสามารถทำปฏิกิริยากับกรดเพื่อสร้างเกลือและก๊าซไฮโดรเจน กลุ่มอัลคาไลน์สามารถทำปฏิกิริยาโดยตรงกับฮาโลเจนเพื่อสร้างเกลือ
องค์ประกอบของโลหะอัลคาไลสามารถระบุได้โดยการทดสอบเปลวไฟ ธาตุแต่ละชนิดจะให้สีที่โดดเด่นเช่นไฟของลิเทียมจะเป็นสีแดงโซเดียมจะเหลืองโพแทสเซียมจะเป็นสีม่วงอ่อนรูบิเดียมจะเป็นสีม่วงและซีเซียมจะเป็นสีน้ำเงิน
กลุ่มดินอัลคาไลน์
โลหะอัลคาไลน์เอิร์ ธ หมายถึงธาตุที่อยู่ในกลุ่ม IIA ได้แก่ เบริลเลียม (Be) แมกนีเซียม (Mg) แคลเซียม (Ca) สตรอนเทียม (Sr) แบเรียม (Ba) และเรเดียม (Ra) จากคุณสมบัติทางกายภาพโลหะอัลคาไลน์เอิร์ ธ มีจุดหลอมเหลวจุดเดือดความหนาแน่นและความแข็งของวัสดุสูงกว่าโลหะอัลคาไลน์เช่นคาบ เนื่องจากองค์ประกอบของโลหะอัลคาไลน์เอิร์ ธ มีอิเล็กตรอนสองตัวในเปลือกนอกดังนั้นพันธะโลหะจึงแข็งแกร่งขึ้น โลหะอัลคาไลน์เอิร์ ธ โดยทั่วไปละลายในน้ำได้ยากและมีอยู่ทั่วไปใต้ดินหรือในหินของเปลือกโลก
คุณสมบัติทางเคมีบางประการของธาตุโลหะอัลคาไลน์เอิร์ ธ คือสามารถทำปฏิกิริยากับน้ำและก่อตัวเป็นฐานได้ นอกจากนี้เมื่อทำปฏิกิริยากับออกซิเจนโลหะอัลคาไลน์เอิร์ ธ สามารถสร้างอัลคาไลน์ออกไซด์ได้ โลหะอัลคาไลน์เอิร์ ธ ยังสามารถทำปฏิกิริยากับไฮโดรเจนเพื่อให้สารประกอบไฮไดรด์ ถ้าทำปฏิกิริยากับไนโตรเจนจะกลายเป็นไนไตรด์
เมื่อเผาแล้วธาตุอัลคาไลน์เอิร์ ธ ก็ให้สีที่โดดเด่นเช่นกัน เปลวไฟของเบริลเลียมและแมกนีเซียมจะเป็นสีขาวแคลเซียมจะเป็นสีส้มสตรอนเทียมจะเป็นสีแดงและแบเรียมจะเป็นสีเขียว
องค์ประกอบฮาโลเจน
ฮาโลเจนประกอบด้วยองค์ประกอบที่อยู่ในกลุ่ม VIIA และประกอบด้วยฟลูออรีน (F) คลอรีน (Cl) โบรมีน (Br) ไอโอดีน (I) และแอสทาทีน (At) ชื่อฮาโลเจนมาจากภาษากรีกแปลว่า "ปั้นเกลือ" ดังนั้นองค์ประกอบของฮาโลเจนสามารถสร้างสารประกอบเกลือได้เมื่อทำปฏิกิริยากับธาตุโลหะ ธรรมชาติ, ฮาโลเจนที่พบในรูปแบบของโมเลกุลคือเอฟ2 , Cl 2 , BR 2และผม2
คุณสมบัติทางกายภาพของฮาโลเจนคือจุดหลอมเหลวและจุดเดือดจะเพิ่มขึ้นตามเลขอะตอมที่เพิ่มขึ้น ที่อุณหภูมิห้องฟลูออรีนและคลอรีนเป็นก๊าซในขณะที่โบรมีนเป็นของเหลวที่ระเหยได้และไอโอดีนเป็นของแข็งที่ระเหิดได้ ฟลูออรีนมีสีเหลืองอ่อนคลอรีนเป็นสีเหลืองอมเขียวและโบรมีนมีสีน้ำตาลแดง เมื่อเป็นของแข็งไอโอดีนจะมีสีดำ แต่ไอเป็นสีม่วง องค์ประกอบฮาโลเจนทั้งหมดมีกลิ่นที่ไม่เหมาะสม
คุณสมบัติทางเคมีขององค์ประกอบฮาโลเจนคือมีปฏิกิริยาสูงเป็นองค์ประกอบที่ไม่ใช่โลหะ ฮาโลเจนสามารถทำปฏิกิริยากับไฮโดรเจนเพื่อสร้างกรดฮาโลเจน เมื่อทำปฏิกิริยากับเบสฮาโลเจนจะรวมตัวเป็นเกลือ เมื่อทำปฏิกิริยากับโลหะฮาโลเจนจะผลิตโลหะฮาโลเจนไนด์ซึ่งมีเลขออกซิเดชันสูง องค์ประกอบของฮาโลเจนยังละลายในน้ำกลายเป็นกรดฮาโลเจนไนด์และกรดไฮโปฮาลิติก สารละลายฮาโลเจนเรียกอีกอย่างว่าฮาโลเจนไนด์และเป็นตัวออกซิไดซ์
โนเบิลแก๊ส
องค์ประกอบของก๊าซที่หายากอยู่ในกลุ่ม VIIIA และประกอบด้วยฮีเลียม (He) นีออน (Ne) อาร์กอน (Ar) คริปทอน (Kr) ซีนอน (Xe) และเรดอน (Rn) ก๊าซหายากได้รับชื่อเนื่องจากที่อุณหภูมิห้องเป็นก๊าซและมีความเสถียรมากหรือทำปฏิกิริยาได้ยาก ก๊าซที่หายากมักพบเป็นอะตอมเดี่ยวในธรรมชาติ
คุณสมบัติทางกายภาพของก๊าซมีตระกูล ได้แก่ จุดหลอมเหลวและจุดเดือดที่ต่ำมาก จุดเดือดของมันอยู่ใกล้กับศูนย์องศาเคลวินและจุดเดือดของมันอยู่เหนือจุดหลอมเหลวเพียงไม่กี่องศา ก๊าซมีตระกูลจะละลายหรือแข็งตัวก็ต่อเมื่อพลังงานของโมเลกุลนั้นอ่อนแอมากนั่นคือที่อุณหภูมิต่ำมาก
ขึ้นอยู่กับคุณสมบัติทางเคมีของพวกเขาก๊าซมีตระกูลมีปฏิกิริยาต่ำมาก สิ่งนี้คิดว่าได้รับอิทธิพลจากโครงร่างของอิเล็กตรอน ก๊าซมีตระกูลมีอิเล็กตรอน 8 ตัวในเปลือกนอก (สองตัวสำหรับฮีเลียม) และเป็นโครงร่างที่เสถียรที่สุด นอกจากนี้ยิ่งรัศมีอะตอมขององค์ประกอบก๊าซมีตระกูลมากขึ้นความสามารถในการเกิดปฏิกิริยาก็จะยิ่งสูงขึ้น จนถึงปัจจุบันนักวิทยาศาสตร์สามารถสร้างสารประกอบจากซีนอนเรดอนและคริปทอนได้
ช่วงที่สาม
องค์ประกอบช่วงเวลาที่สามประกอบด้วยโลหะ (โซเดียมแมกนีเซียมอลูมิเนียม) โลหะผสม (ซิลิคอน) และอโลหะ (ฟอสฟอรัสกำมะถันคลอรีนอาร์กอน) ขึ้นอยู่กับคุณสมบัติทางกายภาพของพวกมันค่าอิเล็กโทรเนกาติวิตีขององค์ประกอบของช่วงเวลาที่สามจะเพิ่มสิทธิมากขึ้นในตารางธาตุ เนื่องจากรัศมีอะตอมไปทางขวายิ่งมีขนาดเล็กลง
ในขณะเดียวกันคุณสมบัติทางเคมีขององค์ประกอบของช่วงเวลาที่สามก็แตกต่างกันไป โซเดียมเป็นตัวรีดิวซ์ที่แข็งแกร่งที่สุดในขณะที่คลอรีนเป็นตัวออกซิไดซ์ที่แข็งแกร่งที่สุด คุณสมบัติของไฮดรอกไซด์ของธาตุเหล่านี้ขึ้นอยู่กับพลังงานไอออไนเซชัน
ช่วงที่สี่
องค์ประกอบที่รวมอยู่ในช่วงที่สี่ ได้แก่ สแกนเดียม (Sc), ไทเทเนียม (Ti), วานาเดียม (V), โครเมียม (Cr), แมงกานีส (Mn), เหล็ก (Fe), โคบอลต์ (Co), นิกเกิล (Ni), ทองแดง (Cu) และสังกะสี (Zn) องค์ประกอบทั้งหมดนี้รวมอยู่ในโลหะซึ่งเป็นตัวรีดิวซ์ จุดหลอมเหลวและจุดเดือดมักจะสูง นอกจากนี้ยังมีการนำไฟฟ้าที่ดีและเป็นวัสดุที่มีความเหนียว Scandium และสังกะสีเป็นสีขาวในขณะที่องค์ประกอบที่เหลือมีหลายสี
จากคุณสมบัติทางเคมีองค์ประกอบการเปลี่ยนแปลงเหล่านี้ส่วนใหญ่มีเลขออกซิเดชันหลายตัวและสามารถสร้างไอออนและสารประกอบเชิงซ้อนได้