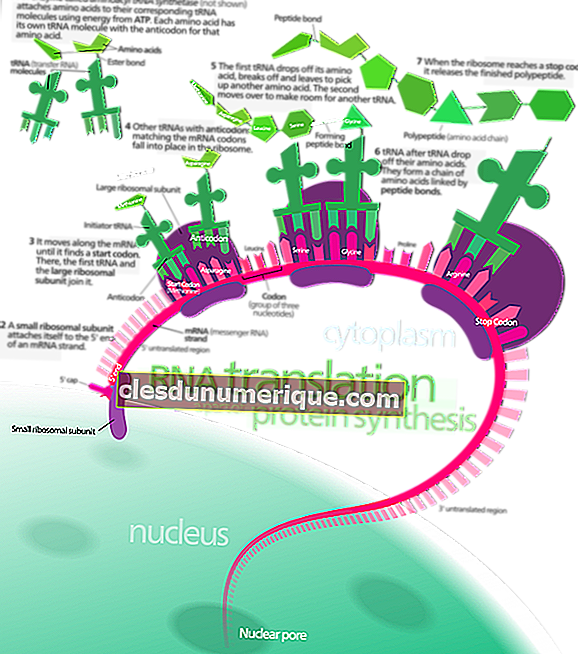
เคมีเป็นสาขาหนึ่งของวิทยาศาสตร์ที่ศึกษาองค์ประกอบโครงสร้างคุณสมบัติการเปลี่ยนแปลงและปฏิสัมพันธ์ของสสาร ในวิชาเคมีมีกฎหมายพื้นฐานที่บังคับใช้ กฎหมายเหล่านี้เรียกว่ากฎพื้นฐานของเคมี
กฎพื้นฐานของเคมีแบ่งออกเป็นสองประเภท ได้แก่ กฎที่เกี่ยวข้องกับมวลของธาตุและกฎที่เกี่ยวข้องกับปริมาตรของก๊าซที่ทำปฏิกิริยา กฎที่ควบคุมมวลขององค์ประกอบประกอบด้วยกฎการอนุรักษ์มวลและกฎของสัดส่วนคงที่ ในขณะเดียวกันกฎหมายที่เกี่ยวข้องกับปริมาตรของก๊าซที่ทำปฏิกิริยาคือกฎของสัดส่วนหลายประการกฎหมายปริมาณก๊าซเกย์ - ลัสซัคและกฎหมายของอโวกาโดร
กฎหมายเหล่านี้ควบคุมอะไรและใช้กับเคมีอย่างไร? ลองดูการอภิปรายในบทความนี้
กฎหมายว่าด้วยการอนุรักษ์มวล
กฎข้อแรกในกฎพื้นฐานของเคมีคือกฎการอนุรักษ์มวล กฎหมายนี้ระบุว่าในระหว่างการเปลี่ยนแปลงทางกายภาพหรือทางเคมีมวลรวมของผลิตภัณฑ์จะเท่ากับมวลรวมของสารตั้งต้น ซึ่งหมายความว่าเมื่อเกิดการเปลี่ยนแปลงทางเคมีสสารจะไม่ถูกสร้างขึ้นหรือถูกทำลาย แต่มีการเปลี่ยนแปลงเท่านั้น
ตัวอย่างเช่นหากมีเมอร์คิวริกออกไซด์ 100 กรัมมวลของผลิตภัณฑ์จะยังคงเป็น 100 กรัมแม้ว่าแบบฟอร์มจะประกอบด้วยปรอท 92.61 กรัมและออกซิเจน 7.39 ก็ตาม นั่นคือมวลรวมของสารตั้งต้น = มวลรวมของผลิตภัณฑ์ = 100 กรัม
กฎของการเปรียบเทียบแบบคงที่
ในกฎของการเปรียบเทียบค่าคงที่สารประกอบทางเคมีมักมีองค์ประกอบเดียวกันรวมกันในสัดส่วนคงที่ตามมวลโดยไม่คำนึงถึงแหล่งที่มา ตัวอย่างเช่นคาร์บอนไดออกไซด์สามารถเตรียมได้หลายวิธี
ประการแรกคือการเผาถ่านหินในอากาศและสามารถกำหนดได้โดย:

ประการที่สองโดยการให้ความร้อนหินปูนด้วยสูตรต่อไปนี้

ประการที่สามคือการให้ความร้อนโซเดียมไบคาร์บอเนต

กฎของการเปรียบเทียบหลายรายการ
หนึ่งในกฎพื้นฐานของเคมีที่เกี่ยวข้องกับปริมาตรของก๊าซที่เกิดปฏิกิริยาคือกฎของสัดส่วนที่หลากหลาย กฎของสัดส่วนหลายส่วนระบุว่าเมื่อองค์ประกอบสององค์ประกอบรวมกันเป็นสารประกอบตั้งแต่สองชนิดขึ้นไปมวลที่แตกต่างกันขององค์ประกอบหนึ่งซึ่งรวมกับมวลคงที่ของอีกองค์ประกอบหนึ่งจะมีอัตราส่วนจำนวนเต็มอย่างง่ายซึ่งกันและกัน
เราสามารถดูตัวอย่างได้ในแผนภูมิด้านล่าง

มวลของออกซิเจนรวมกับมวลคงที่ของคาร์บอน 12 มีอัตราส่วนจำนวนเต็มอย่างง่ายเป็น 16:32 หรือ 1: 2
กฎของปริมาณก๊าซเกย์ - ลัสซัค
กฎของปริมาณก๊าซเกย์ - ลัสซัคระบุว่าปริมาตรของก๊าซที่ทำปฏิกิริยาและปริมาตรของก๊าซที่เกิดปฏิกิริยาเป็นสัดส่วนเป็นจำนวนเต็มอย่างง่ายเมื่อวัดที่อุณหภูมิและความดันเดียวกัน ตัวอย่างอยู่ในสูตรต่อไปนี้

อัตราส่วนโมล = 1: 3: 2
ตามกฎของ Gay-Lussac อัตราส่วนโมลของก๊าซจะเท่ากับปริมาตรของก๊าซและผลิตภัณฑ์ที่ทำปฏิกิริยา ในสูตรข้างต้นก๊าซไนโตรเจน 1 ลิตรทำปฏิกิริยากับก๊าซไฮโดรเจน 3 ลิตรเพื่อผลิตแอมโมเนีย 2 ลิตร
กฎหมายของ Avogadro
กฎพื้นฐานสุดท้ายของเคมีคือกฎของ Avogadro กฎของ Avogadro ระบุว่าภายใต้สภาวะที่มีความดันและอุณหภูมิเท่ากันก๊าซอุดมคติในปริมาตรเดียวกันจะมีโมเลกุลจำนวนเท่ากัน ตัวอย่างเช่นเราสามารถดูได้จากตารางด้านล่าง