ในบทความก่อนหน้านี้เราได้กล่าวถึงปฏิกิริยารีดอกซ์คืออะไร ปฏิกิริยารีดอกซ์ที่ใช้กันทั่วไปในสาขาเภสัชศาสตร์ชีววิทยาอุตสาหกรรมโลหะวิทยาและการเกษตรเป็นปฏิกิริยาออกซิเดชั่นและปฏิกิริยารีดักชันที่เกิดขึ้นพร้อมกัน ในระหว่างปฏิกิริยารีดอกซ์จำนวนอิเล็กตรอนที่สูญเสียจะเท่ากับจำนวนอิเล็กตรอนที่ได้รับ
ปฏิกิริยารีดอกซ์ประกอบด้วยปฏิกิริยารีดักชันและปฏิกิริยาออกซิเดชั่น การรีดักชันคือกระบวนการกำจัดออกซิเจนหรือองค์ประกอบอิเล็กโทรเนกาติวิตีออกจากสารหรือการเติมไฮโดรเจนหรือองค์ประกอบอิเล็กโทรโพซิทีฟให้กับสาร ในขณะเดียวกันการออกซิเดชั่นคือการเติมออกซิเจนหรือองค์ประกอบอิเล็กโทรเนกาติวิตีลงในสารหรือการกำจัดไฮโดรเจนหรือองค์ประกอบอิเล็กโทรโพซิทีฟใด ๆ ออกจากสาร
มีปฏิกิริยารีดอกซ์หลายประเภทที่เราคุ้นเคย ได้แก่ ปฏิกิริยารวมการสลายตัวการแลกเปลี่ยนและการไม่ได้สัดส่วน
ปฏิกิริยาการรวมกัน
ปฏิกิริยารวมคือปฏิกิริยาเมื่อองค์ประกอบตั้งแต่สององค์ประกอบขึ้นไปรวมกันเป็นสารประกอบเดี่ยว
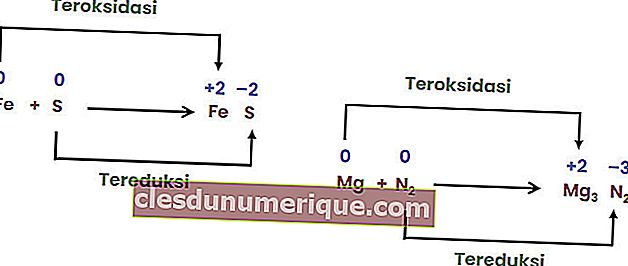
ปฏิกิริยาการสลายตัว
ปฏิกิริยาการสลายตัวหรือการสลายตัวคือปฏิกิริยาเมื่อสารประกอบแตกตัวหรือแตกตัวออกเป็นสารหรือองค์ประกอบที่เรียบง่ายสองชนิดหรือมากกว่า ปฏิกิริยาการสลายตัวมักเรียกว่าตรงกันข้ามกับปฏิกิริยารวม
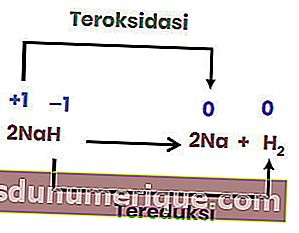
อย่างไรก็ตามปฏิกิริยาการสลายตัวไม่ใช่ทั้งหมดเป็นปฏิกิริยารีดอกซ์ ตัวอย่างคือปฏิกิริยาต่อไปนี้
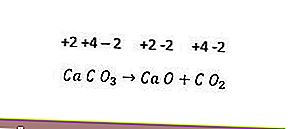
เนื่องจากไม่มีการเปลี่ยนแปลงเลขออกซิเดชันของแต่ละองค์ประกอบปฏิกิริยาข้างต้นจึงไม่ใช่ปฏิกิริยารีดอกซ์ เพื่อให้ปฏิกิริยาการสลายตัวกลายเป็นปฏิกิริยารีดอกซ์อย่างน้อยหนึ่งในองค์ประกอบที่เกิดขึ้นจะต้องอยู่ในรูปของธาตุ
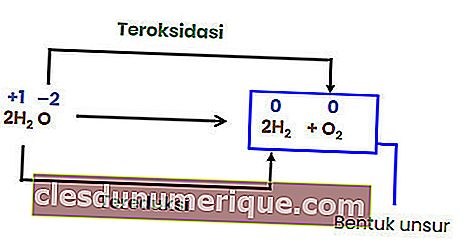
ปฏิกิริยาการแลกเปลี่ยน
ปฏิกิริยาการแลกเปลี่ยนหรือการแทนที่คือปฏิกิริยาที่อะตอมหรือไอออนในสารประกอบถูกแทนที่ด้วยอะตอมหรือไอออนจากสารประกอบอื่น ปฏิกิริยาการเปลี่ยนจะแบ่งออกเป็นการเปลี่ยนโลหะและอโลหะ
(อ่านเพิ่มเติม: ค้นหาเกี่ยวกับปฏิกิริยารีดอกซ์)
การเปลี่ยนโลหะเกิดขึ้นเมื่อโลหะในสารประกอบถูกแทนที่ด้วยโลหะที่มีปฏิกิริยามากกว่าในสถานะอิสระ ตัวอย่างคือปฏิกิริยาด้านล่าง

ปฏิกิริยาการเปลี่ยนโลหะมีประโยชน์ในกระบวนการทางโลหะวิทยาเมื่อได้โลหะบริสุทธิ์จากสารประกอบที่มีอยู่ในแร่
ในขณะเดียวกันปฏิกิริยาทดแทนที่ไม่ใช่โลหะ ได้แก่ การเปลี่ยนไฮโดรเจนฮาโลเจนและบางครั้งออกซิเจน โลหะอัลคาไลทั้งหมดและโลหะอัลคาไลน์เอิร์ ธ (Ca, Sr และ Ba) แทนที่ไฮโดรเจนจากน้ำเย็น ตัวอย่างสามารถเห็นได้จากปฏิกิริยาต่อไปนี้
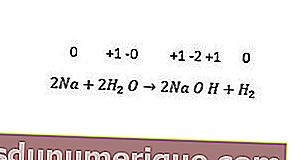
ปฏิกิริยาไม่สมส่วน
ปฏิกิริยารีดอกซ์ประเภทสุดท้ายคือการไม่ได้สัดส่วน ปฏิกิริยานี้เกิดขึ้นเมื่อองค์ประกอบเดียวกันถูกออกซิไดซ์พร้อมกันและลดลง องค์ประกอบที่มีเลขออกซิเดชันตั้งแต่สามตัวขึ้นไปสามารถทำหน้าที่เป็นตัวออกซิไดซ์และตัวรีดิวซ์ได้เอง ตัวอย่างคือปฏิกิริยาต่อไปนี้
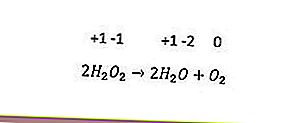
ในปฏิกิริยาข้างต้นเลขออกซิเดชันของออกซิเจน (-1) จะลดลงเป็น -2 และออกซิไดซ์เป็น 0









